全球不孕不育率持续上升,如今已接近15%-20%,成为仅次于癌症、心脑血管疾病的人类第三大健康问题。
从细胞生物学与遗传学角度出发,复旦大学生物医学研究院王磊、桑庆、武田宇团队研究成果揭示了人类卵母细胞纺锤体双极化机制,为生殖障碍疾病的研究与治疗提供了重要的解释视角与理论支持。成果以“Mechanisms of minor pole-mediated spindle bipolarization in human oocytes”为题发表在最新一期的《科学》杂志(Science)。

破解人卵母细胞成熟障碍之谜,初步发现人卵纺锤体具有独特性
据估计,全球有6000-8000万对夫妇面临不孕之苦,有数百万人进行试管婴儿治疗,但临床中时常遇到卵子、授精及胚胎发育异常的情况,然而人们对这些异常背后的原因及机制所知甚少。

面对这一现状,复旦大学生物医学研究院教授王磊十多年前提出研究假设:遗传因素可能是导致人卵成熟与发育异常的重要原因之一。
通过深入攻关,2016年,王磊/桑庆团队发现人类卵子成熟障碍的第一个致病基因——灵长类特异β-微管蛋白TUBB8,从而明确了此疾病为人类新遗传病。该基因可解释约30%卵母细胞成熟障碍患者,如今已广泛应用于临床检测。继TUBB8之后,团队又陆续发现24个人类卵子成熟障碍的致病基因并明确了机制。由于一系列研究,团队受science邀请撰写综述。

研究论文“TUBB8基因突变致人类卵子减数分裂阻滞”(Mutations in TUBB8 and Human Oocyte Meiotic Arrest)在《新英格兰医学杂志》(The NEW ENGLAND JOURNAL of MEDICINE)发表

团队受Science邀请,撰写不孕不育遗传学综述
纺锤体的存在及其正常与否,直接决定了卵子是否能够正常成熟与受精。作为人卵纺锤体的主要组成部分,灵长类特异基因TUBB8的发现,标志着人类卵子成熟障碍机制研究迈出了第一步,同时也表明人卵纺锤体成分具有独特性。
那么,更为深层的核心问题在于:人卵如何从零开始组装成一个纺锤体?纺锤体是如何发展成为双极纺锤体的?为厘清生理机制,王磊/桑庆/武田宇团队持续深耕,将研究聚焦至人卵纺锤体组装的早期阶段,即微管聚合机制研究。

研究成果以“The mechanism of acentrosomal spindle assembly in human oocytes”为题,发表在《科学》杂志(Science)
2022年,团队发现人卵中存在一种独特的微管组织中心,将其命名为huoMTOC,进一步揭示人卵纺锤体的独特之处,打破了此前学界普遍认为人卵中没有微管组织中心结构的观点。
这一发现也破解了纺锤体组装的第一个环节,即微管聚合启动——人卵母细胞中的微管如何由原本散布的状态变为聚合状态。
首次描述人卵纺锤体组装过程,进一步揭示出独特机制
纺锤体微管聚合启动之后,最终双极状纺锤体如何形成?这是纺锤体组装过程的第二个重要环节,其中涉及纺锤体双极化过程中有哪些关键分子参与、双极化异常又将如何导致生殖障碍发生等关键问题。
王磊/桑庆/武田宇团队围绕第二环节持续突破,其最新研究成果不仅首次描述了人卵双极纺锤体形成的完整过程,还明确了3个关键蛋白质在纺锤体双极化中的作用。
研究显示,人卵纺锤体微管聚合启动后会经历一段较长时间的 “多极纺锤体”(Multipolar spindle)阶段,而后才形成双极状纺锤体,同时发现了调控纺锤体双极化的关键蛋白,并在临床多个卵子和胚胎发育异常患者中,鉴定到编码这些关键蛋白的基因存在突变,从而揭示了人卵纺锤体双极化的独特生理病理机制。
团队通过免疫荧光和活细胞时间序列成像技术,首次对减数分裂开始后纺锤体的组装过程进行了高清晰度的实时观察。结果显示,人卵母细胞核膜破裂之后,染色体动粒会相聚成簇。随后,新生微管负端在动粒附近聚合并初步形成纺锤体的极,将其命名为“小极(Minor pole)”。
在第一次减数分裂前中期,多个“小极”组装形成典型的“多极纺锤体”,多极纺锤体状态持续长达7-9个小时。在此期间,小极的数目逐渐增多并聚集,直到第一次减数分裂中期形成两个“大极(Major pole)”,最终完成纺锤体双极化过程-多极纺锤体转变为双极纺锤体。“以上过程与有丝分裂及其他哺乳动物卵母细胞的纺锤体双极化过程截然不同,进一步展现出人卵纺锤体组装的独特机制。”王磊强调。
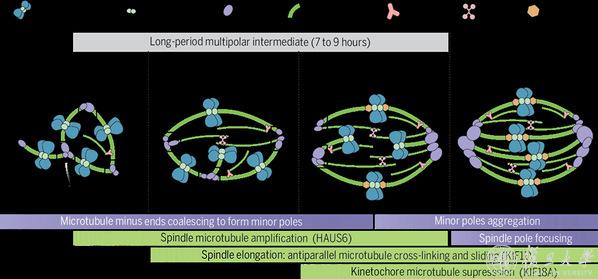
人卵双极纺锤体形成机制
研究人员通过筛选发现了3种蛋白(HAUS6,KIF11和KIF18A)的缺失会导致人卵纺锤体双极化失败:HAUS6通过促进微管的扩增为纺锤体双极化提供物质基础;KIF11通过调控微管间的交联和相对滑动实现纺锤体的双向延伸;KIF18A通过抑制微管的过度生长维持纺锤体的稳定性。这3种蛋白相互配合,在人卵纺锤体双极化建立过程中发挥了重要作用。
在卵子和胚胎发育异常患者中进行的突变筛查显示,11位患者分别携带以上3种蛋白的致病突变,这些突变位点会引起不同程度的纺锤体双极化异常,从而导致卵母细胞成熟障碍、受精失败及早期胚胎发育停滞。
基础研究与临床诊疗密切结合,有望提供精准诊疗方案
这项成果不仅揭示了人卵纺锤体组装的独特机制,也为临床生殖障碍疾病的诊疗提供了理论依据。
“临床治疗离不开基础研究的支撑。”在王磊看来,只有了解清楚疾病发生的机制,才能针对这些机制和分子设计出有效的治疗策略,也正因此,研究的全过程与临床紧密结合。目前,团队正积极探索可以逆转由基因突变引起的纺锤体双极化异常的治疗策略。

王磊/桑庆团队合影
“我们对人卵纺锤体组装的理解还处于初级阶段,许多细节仍有待探索。比如纺锤体组装完成后,纺锤体如何移动,如何排出第一极体等问题,都尚不明确。”王磊说。
长远来看,团队希望全面揭示人类生殖过程中的独特生理与病理机制,特别是卵子受精和胚胎发育方面。“人类在这些方面与小鼠以及其他哺乳动物存在显著差异,而这些差异现在看来,只是冰山一角。”王磊表示,迄今为止,团队通过一系列研究已揭示人类多项独特生理机制,随着研究不断深入,人类卵子发育独特性的全貌有望被进一步揭开。
从临床到基础再回到临床,通过解决基础科学问题最终使广大疾病患者受益,是团队共同的心愿。“这是一个长期目标,但每一步进展都为未来疾病的治疗带来希望。”
复旦大学生物医学研究院王磊、桑庆,上海交通大学附属国际和平妇幼保健院李文为通讯作者。复旦大学生物医学研究院武田宇、罗宇茜,上海交通大学附属国际和平妇幼保健院章美玲,上海市生物医药技术研究院陈标榜为本文的共同第一作者。此外,上海集爱遗传与不育诊疗中心孙晓溪、上海交通大学附属第九人民医院生殖中心匡延平、复旦大学附属妇产科医院金莉萍、河北医科大学第二医院郝桂敏、西北妇女儿童医院师娟子、广西壮族自治区生殖医院牛向丽也参与了该项研究。
文章链接:https://www.science.org/doi/10.1126/science.ado1022
新闻链接:https://news.fudan.edu.cn/2024/0823/c31a141941/page.htm