全球新冠病毒疫情形势严峻,已确定感染者超4.4亿人,死亡人数突破600万。由于新冠病毒频繁的发生突变,导致其对中和抗体和疫苗产生免疫逃逸,屡屡冲击防疫“防线”。尤其是奥米克戎变异流行株的出现,使得很多具有很好中和活性的抗体几乎完全失效,新冠疫苗的保护效果也大大被削弱。另一方面,新冠病毒的感染往往集中在呼吸道和肺部,血液中病毒很少,而单抗药物一般只能通过静脉或皮下等注射方式给药,使得抗体难以有效到达肺部。这些因素给新冠广谱疫苗和药物的研发带来了巨大的挑战。

2022年3月9日,复旦大学基础医学院应天雷与吴艳玲课题组与生物医学研究院孙蕾课题组合作,在《细胞》(Cell)杂志上发表了题为“Broad neutralization of SARS-CoV-2 variants by an inhalable bispecific single-domain antibody” 的研究论文,报道了一种抗新冠病毒的广谱双特异性全人源纳米抗体,该抗体同时靶向病毒刺突蛋白上两个不同的保守表位,能够高效中和包括奥米克戎在内的各种流行变异株。同时,该抗体具有的优良特性使其可作为雾化吸入制剂,在新冠病毒感染的轻症和重症小鼠模型中显现出很好的疗效。
自新冠疫情暴发以来,一系列新冠变异流行株迭次出现。近期在全球大范围传播的奥米克戎流行变异株(Omicron),其刺突蛋白 (Spike) 的受体结合域 (RBD) 上有多达15个突变,远超过之前出现的变异株,所以免疫逃逸能力更强。研究团队首先对Omicron的免疫逃逸特性进行了分析,发现病毒对靶向其头部受体结合区(RBM)的抗体逃逸最严重。一些已上市的针对RBM的新冠单抗已完全失效,且接种疫苗的志愿者如果血液中产生了更多的RBM抗体,则其血清对Omicron的中和活性就更弱。
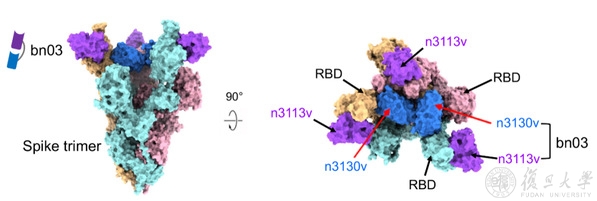
进一步,团队发现Omicron的RBD虽然发生了不少突变,但还是有两个区域未发生明显的免疫逃逸,一个是其朝向外侧的侧面区的一部分,另一个隐藏在三聚体内部。在前期研究中,应天雷团队曾建立了一种创新的全人源纳米抗体研发体系,并针对RBD不同区域筛选到了一系列高亲和力全人源纳米抗体(Cell Host Microbe, 2020)。在本论文中,团队将分别针对以上两个保守区域的两株全人源纳米抗体(n3113v和n3130v)通过适当长度的连接子串联,获得了一株分子量仅为27 kDa的小体积双特异性全人源纳米抗体(bn03),抗体理化性质优,能强效结合和中和所有的流行突变株。为了阐明抗体的作用机制,研究人员解析了全人源纳米双抗与Omicron三聚体S蛋白的结构,发现双抗两端的n3113v和n3130v可同时结合于同一个RBD上,而且一个三聚体S蛋白可同时结合3个bn03双抗。此外,n3130v的结合使“down”状态的RBD往三聚体轴线内部拉进了约13 Å,让侧面表位更多暴露,使得n3113v也能更好的结合RBD,说明了双抗的协同作用机制。更有意思的是,n3130v的表位隐藏在三聚体内部,所有的结合位点在新冠病毒高频突变株中均没有突变,是目前发现的最广谱的表位。此前团队报道的与新冠和SARS-CoV都可高亲和力结合的单抗CR3022也靶向类似表位,但n3130v和双抗bn03由于体积更小,可以更充分进入空间狭小的三聚体内部并与隐藏表位紧密结合,造成三聚体快速解体,所以具有更强的中和活性。
更重要的是,单抗等生物大分子药物往往只能注射给药,为了达到有效肺部药物浓度需要使用很高的给药剂量,增加了药物的成本和副作用的风险。与经典的单抗不同,研究团队发现全人源纳米双抗可以有效的通过雾化方式给药,形成大量中位粒径在5微米以下的雾化液滴,并且雾化后不影响双抗的活性,也不会造成双抗的降解或者聚集。在新冠病毒感染的hACE2人源化小鼠的轻症和重症模型中,雾化吸入双抗都显著降低小鼠肺部的病毒滴度并改善了肺部病理状态。
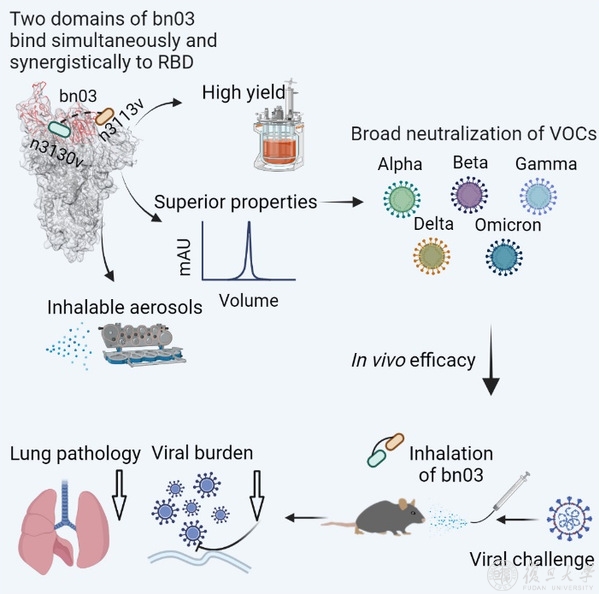
综上所述,该双抗有望成为首个通过雾化给药方式的广谱全人源纳米抗体药物,用于新冠肺炎的特效治疗。论文还发现了一类隐藏在病毒刺突蛋白三聚体内部的高度保守表位,对广谱疫苗和药物的研发具有启示作用。目前该双抗已进入中试生产阶段,正在加快向临床试验推进。
复旦大学基础医学院、上海市重大传染病和生物安全研究院应天雷研究员、复旦大学生物医学研究院孙蕾研究员、复旦大学基础医学院吴艳玲副研究员为该研究的共同通讯作者,复旦大学基础医学院博士生李澄,生物医学研究院博士生詹屋强,复旦大学附属中山医院青年研究员杨振霖,上海博奥明赛生物科技有限公司CEO涂超及复旦大学三级生物安全防护实验室胡高维为该研究的共同第一作者。该研究得到复旦大学基础医学院医学分子病毒重点实验室姜世勃教授,陆路研究员,朱园飞博士,上海博奥明赛张毅博士及复星医药崔志平先生等人的大力支持和协助。
论文链接:
https://www.cell.com/cell/fulltext/S0092-8674(22)00269-0
专家点评
闻玉梅(中国工程院院士)
攻克新冠病毒面临两大难题。其一,病毒非常容易发生免疫逃逸,使得疫苗与中和抗体失效。其二,病毒主要感染部位在呼吸道和肺部,但抗体主要在血液里,很难有效递送到病灶部位。应天雷/孙蕾/吴艳玲团队同时针对以上两大难题做了很有价值的系统性研究工作。
一方面,团队发现了一个非常保守的表位,深藏在病毒的S蛋白三聚体内部。从奥米克戎可以充分看出,新冠病毒可以“换脸”,也就是把刺突蛋白表面容易被抗体攻击的地方突变掉,但是很难“换心”:团队发现的这个“隐藏表位”不仅在奥米克戎上相当保守,而且在疫情暴发迄今出现的数十个病毒高频突变株中也都没发生任何变化。实际上,在其它病毒上也存在类似的表位:应天雷团队2017年就在Cell Host Microbe发表了封面论文,首次报道了流感病毒表面存在这种隐藏很深的抗体表位,并将其命名为“三聚体隐藏表位”。后续多个独立研究团队都在流感病毒中证实了这类表位的存在,也找到了攻击这个表位的抗流感病毒广谱中和抗体。这次新冠病毒中又发现了这类表位,说明很多种不同的病毒都可能存在这种藏在包膜三聚体里面的表位。团队还证实了,新冠病毒的这类表位藏的很深,不容易被免疫系统攻击,所以很少发生突变。这对广谱疫苗和药物的开发很有借鉴意义。
另一方面,这种隐藏表位的抗体很罕见,特别是有很好中和活性的抗体更难找到。实际上,应天雷团队在新冠疫情刚暴发的一个月后就在国际上率先报道了首个新冠病毒高亲和力单抗CR3022。该单抗由团队第一时间免费分享给国内外数十家单位,被广泛用于新冠病毒检测及疫苗药物的研发。在后续研究中,多个独立研究团队证实CR3022就是结合在新冠病毒的三聚体隐藏表位,但钻的不够深,所以虽然能够高亲和力的广谱结合SARS和新冠病毒,但对病毒的中和活性相对较弱。为了解决这个问题,团队研发了一种非常创新的“全人源纳米抗体“,体积只有单抗CR3022的十分之一,所以能更深的钻进三聚体隐藏表位,具有很好的中和活性,对新冠毒株突变株也更广谱。
特别是,团队还通过与产业界合作,证实了在同样实验条件下经典的IgG单抗无法被有效雾化,但全人源纳米抗体由于分子量小、理化性质优异,能够非常有效的通过雾化方式迅速递送到呼吸道、肺泡等新冠感染的病灶部位。团队在复旦大学生物安全三级实验室内建立了雾化给药的新冠感染小鼠模型,发现雾化的新型抗体在轻症与重症新冠感染小鼠模型中均能够有效的抑制病毒感染,证实了抗体的有效性和临床潜力。该抗体正在推进临床转化,已经进入中试生产阶段,有望被开发成为广谱特效治疗药物。
陈凯先(中国科学院院士)
雾化吸入抗体,治疗新冠肺部感染的新策略
局部给药提高肺部药物浓度
新冠病毒的感染者往往是在呼吸道和肺中检测到大量的病毒,血中病毒滴度偏低甚至检测不到。传统的抗体都是通过注射途径系统性给药,也就意味着抗体需要跨过肺血管屏障,循环到肺中发挥效果。因此,要达到治疗的目的,往往需要相对提高给药剂量,使肺部能够达到有效的药物浓度,这增加了药物成本,也使产生副作用的风险增高。对于肺部感染疾病,肺局部给药是一种值得考虑的给药方式。目前治疗哮喘的吸入型制剂就能有效减小糖皮质激素全身用药的不良反应,还能控制药物浓度。相比传统的全身给药,肺部给药可使药物直接到达肺部发挥作用,起效快,肺局部药物浓度高,全身药物浓度相对偏低。因此,有望减小给药剂量,降低用药成本,并做到无创特效治疗,是治疗新冠感染的值得考虑的给药方式。
新结构抗体药物未来可期
自全球首款纳米抗体药物Cablivi被批准用于治疗血栓性血小板减少性紫癜以来,越来越多的针对不同靶点的纳米抗体药物被报道。纳米抗体比传统抗体分子量小,但对抗原的亲和力仍能达到较高的水平。此外,其被认为有较好的理化性质和较高的产量,因此具备良好的成药性。然而,纳米抗体均来源于骆驼或羊驼,即使人源化后仍然含有一定驼源成分,使得其人体使用存在安全性隐患。本论文报道了一种新型的全人源纳米抗体,其开发利用了作者团队之前建立的创新合成免疫平台,研发过程完全跳过了骆驼,理论上这种新型抗体会具有更低的免疫原性和更好的安全性。这种新结构的抗体也具有良好均一的理化性质,产量高,且用protein A纯化就能拿到纯度很高的双抗,对于简化药物纯化工艺,降低药物成本具有很大的意义。这个工作非常有开拓性,体现了创新的价值,说明新型结构的抗体有望克服经典抗体药物的安全性、高成本等瓶颈,并且可以获得一些新的优异成药特性。
双特异性抗体显示1+1>2的效果
本论文很巧妙的设计了一个小型双抗,仅有27 kDa。从结构上可以发现,这种设计不仅仅可以让双抗的两端同时结合在同一个RBD上,还能利用双抗中的一个抗体与RBD结合,使之发生构象变化,从而辅助双抗中另一个抗体的结合,达到“1+1>2”的效果。本文在动物水平验证了全人源纳米双抗雾化给药后,在新冠病毒感染的轻症和重症小鼠模型中的治疗效果,进一步证实了全人源纳米双抗的优异抗病毒活性,及雾化吸入给药对治疗肺部疾病的优势。更重要的是,该设计将靶向两个保守表位的全人源纳米抗体串联,相当于双保险,更不易产生逃逸。
新闻链接:https://news.fudan.edu.cn/2022/0311/c5a130455/page.htm