如果说基因携带着遗传的“密码”,那么当RNA被甲基团修饰时就如同戴上了一件装饰品,因其调控作用而使“解密”后呈现的“模样”并不完全对应最初的“密码”。RNA被甲基团修饰的结果便是“甲基化”,是表观遗传的重要信号之一。RNA m6A甲基化是近年来RNA领域的研究热点。RNA产生于染色质,染色质环境的维持对于基因组稳定十分重要。在基因组的冷冻区,在这个人们通常认为是“沉默”的区域,是否也有“甲基化开关”的一番操作呢?
复旦大学生物医学研究院、上海市医学表观遗传学重点实验室青年研究员沈宏杰和牛津大学教授Yang Shi合作研究,发现METTL3通过调控内源性逆转录病毒(Endogenous retrovirus)IAPEz亚群上的异染色质状态,进而抑制IAPEz元件转录,即发现RNA m6A对于沉默基因组稳定性的重要调控功能。1月27日,相关研究成果以《METTL3调控小鼠胚胎干细胞异染色质》(“METTL3 regulates heterochromatin in mouse embryonic stem cells”)为题在线发表于《自然》(Nature)主刊。
mRNA上的m6A修饰受到了广泛的关注,其对于mRNA的命运调控涉及其生物学功能的方方面面,包括剪接、转运、降解、翻译等,m6A主要由METTL3/METTL14复合物催化,目前的研究主要集中在METTL3/METTL14对于细胞质中mRNA的调控研究。但是METTL3是否参与以及如何参与调控染色质功能的研究相对较少。内源性逆转录病毒(Endogenous retrovirus)元件是基因组转座子元件之一,约占小鼠基因组的10%,为了阻止这些转座元件在基因组中四处移动造成遗传突变,细胞进化出了相应的表观遗传修饰抑制这些转座子的活性。小鼠胚胎干细胞主要通过H3K9me3和H4K20me3修饰抑制转座子ERV的活性,但是否还有更多的表观遗传修饰参与其中的研究相对较少。

研究发现m6A甲基转移酶METTL3在小鼠胚胎干细胞mESCs染色质主要结合在内源性逆转录病毒(Endogenous retrovirus)IAPEz转座子亚群上。IAPEz转座子主要通过组蛋白H3K9me3和H4K20me3修饰来沉默,H3K9me3主要由甲基转移酶复合物SETDB1/TRIM28复合物催化,H4K40me3则主要由SUV420H1/2催化,并且依赖于H3K9me3。METTL3主要通过招募SETDB1/TRIM28复合物来调控H3K9me3修饰,同时研究者发现METTL3与SETDB1/TRIM28的相互作用不依赖于METTL3的酶活。
同时研究发现METTL3结合IAPEz转座子依赖于METTL3的催化酶活,METTL3的各种酶活突变体都不再结合染色,进一步研究发现METTL3催化的IAPEz RNA促进了m6A识别子蛋白YTHDC1结合染色质,同时YTHDC1反过来促进METTL3在染色质上的结合,形成正向反馈。
研究还讨论了YTH蛋白在裂殖酵母和哺乳细胞中调控异染色质的异同。RNA参与异染色质形成的研究主要集中在裂殖酵母中,裂殖酵母细胞缺少m6A甲基催化酶METTL3同源物,因此YTH同源蛋白Mmi1不识别m6A修饰,而通过识别RNA上的DSR序列参与异染色质形成。而哺乳细胞中YTH同源蛋白YTHDC1通过识别METTL3催化的m6A修饰参与异染色质形成。研究同时还讨论了m6A修饰在RNA的5’UTR和3’UTR可能参与不同的调控作用。
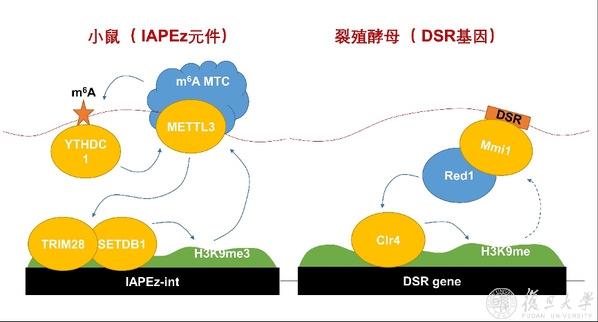
METTL3调控异染色质的工作模型。
(左)哺乳细胞中METTL3/YTHDC1蛋白招募H3K9me3甲基转移酶复合物SETDB1/TRIM28的示意图。
(右)裂殖酵母细胞中Mmi1蛋白参与调控异染色质形成的示意图。
这项工作发现METTL3可以结合小鼠胚胎干细胞ERV中的IAPEz转座子,通过招募SETDB1/TRIM28维持IAPEz转座子上的异染色质状态。
复旦大学生物医学研究院、上海市医学表观遗传学重点实验室为第一署名单位,复旦大学生物医学研究院博士后徐文绮是论文的第一作者,沈宏杰和Yang Shi为论文的共同通讯作者。
原文链接:https://news.fudan.edu.cn/2021/0129/c4a107857/page.htm
论文链接:https://www.nature.com/articles/s41586-021-03210-1