流感病毒每年可造成300-500万人重症感染,25-69万人死亡,对人们的生命健康带来了极大的威胁。而由于流感病毒的血凝素(HA)和神经氨酸酶(NA)基因经常发生突变,每年预测更新的病毒株与流行株之间不匹配,大大限制了疫苗的功效与应用。相比病毒的自然感染以及减毒活疫苗等复制性疫苗,非复制型疫苗引起的粘膜T细胞免疫反应较差,无法诱导较强的保护性免疫反应。因此迫切需要安全、高效的粘膜佐剂来促进机体产生保护性免疫,以应对不同的流感病毒感染带来的威胁。
2020年2月21日,复旦大学基础医学院陆路、姜世勃团队联合哈佛医学院麻省总医院Mei X Wu副教授合作研究成果以Research Article的形式登上《科学》(Science)杂志主刊。论文题为《肺泡活性物质仿生纳米颗粒(PS-GAMP)增强抵御异型流感病毒感染》(“Pulmonary surfactant–biomimetic nanoparticles potentiate heterosubtypic influenza immunity”),揭示了仿生纳米颗粒作为通用流感疫苗粘膜佐剂的作用和机制。
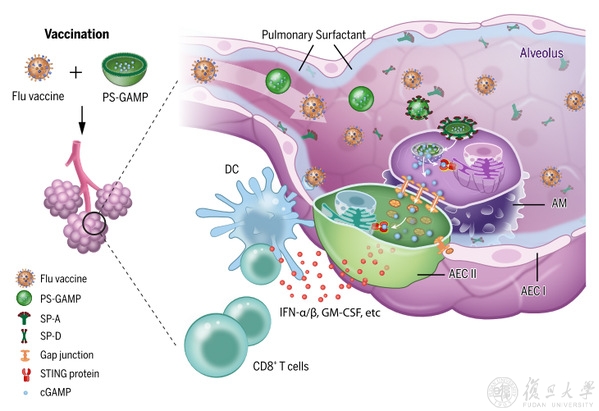
图1. PS-GAMP介导的佐剂活性。在肺泡中,PS-GAMP与SP-A或SP-D结合并凭借其介导的内吞作用进入AMs。PS-GAMP中的cGAMP随后被释放到细胞质中,并通过缝隙连接流入AECs,然后激活这些细胞中的STING信号通路,诱导产生大量的1型免疫介质。这些介质促进了CD11b+树突状细胞的募集和分化,进而介导抗病毒CD8+ T细胞和体液免疫应答。
研究团队基于cGAMP设计制备了一种肺部仿生纳米颗粒(PS-GAMP)来模拟流感病毒肺部感染,发现其能够在不破坏肺部表面活性剂(PS)和肺泡上皮屏障(AEC)的情况下,激活AMs和AECs,促进疫苗产生高效的体液和CD8+ T细胞保护性免疫反应,以抵抗多种异型流感病毒的攻击。研究结果提示AECs在产生广泛的交叉保护以抵御各种流感病毒方面具有十分重要的作用,表明PS-GAMP可能是一种“通用”流感疫苗的潜在粘膜佐剂。

同日,针对本文研究内容,Susanne Herold和Leif-Erik Sander在Science上发表了题为“Toward a universal flu vaccine”的亮点评述,认为评估cGAMP作为粘膜流感疫苗佐剂的功效及其对人和其他流感病毒自然宿主的交叉保护性T细胞的影响至关重要,并提示将有效的通用疫苗佐剂与靶向递送系统及广泛保护性的疫苗抗原结合以引发交叉反应性CD8+ T细胞和交叉保护性抗体,可能是急需的通用流感疫苗的最有效方法。
陆路研究员及姜世勃教授团队长期致力于我国新发再发传染性疾病药物、疫苗研究,MeiX Wu副教授团队专注于仿生递送系统、佐剂等研究,这项成果由两个团队通力合作,开展了近5年的研究工作后完成。目前,团队正聚焦于防治新型冠状病毒药物和疫苗的研究,该成果也为有效预防新冠病毒感染的疫苗研究提供了重要的技术基础。
复旦大学生物安全三级实验室以及基础医学院公共仪器平台对该研究给予重要支持。
新闻链接:https://news.fudan.edu.cn/2020/0221/c4a104116/page.htm