近日,复旦大学生命科学学院李继喜教授与美国哥伦比亚大学、哈佛大学医学院团队合作研究在细胞坏死领域取得重要进展。4月19日,研究成果以《异源淀粉样信号复合物RIPK1-RIPK3坏死小体的结构研究》(“The Structure of the Necrosome RIPK1-RIPK3 Core, a Human Hetero-amyloid Signaling Complex”)为题在线发表于《细胞》(Cell)。
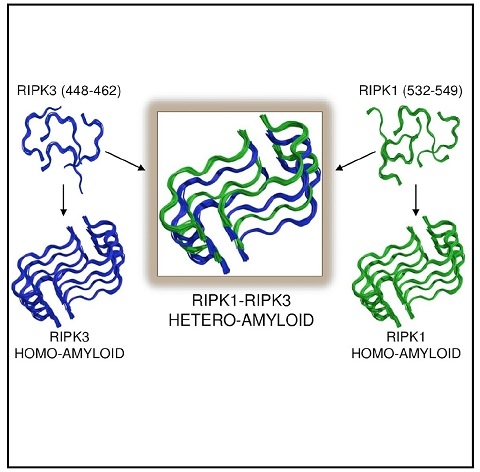
RIPK1-RIPK3形成异源淀粉样信号复合物激活细胞程序性坏死
2012年,李继喜教授发现哺乳动物TNF引起细胞程序性坏死过程中RIP1/RIP3复合物形成功能性淀粉样纤维,通过信号放大平台引起细胞坏死(Li et al 2012,Cell)。经过6年的不懈努力,李继喜教授团队与美国哥伦比亚大学、哈佛大学医学院团队合作通过固体核磁共振技术(ssNMR)和X-光晶体衍射方法首次解析了RIPK1-RIPK3异源淀粉样信号复合物的高分辨率三维结构。
RIPK1-RIPK3坏死小体引起细胞程序性坏死,在人类免疫反应、癌症和神经退行性疾病(如阿尔茨海默症和ALS)中起着重要作用。RIPK1与RIPK3通过RHIM结构域发生相互作用。研究团队发现,RIPK1-RIPK3以1:1的堆积方式形成异源复合物,其中RIPK1上的Ser535和RIPK3上的Cys455形成特殊条带。与RIPK1、RIPK3本身形成的同源淀粉样纤维相比,在同一个β-片层中RIPK1-RIPK3具有更有效的嵌合堆积方式,更大的疏水区域以及最稳定的能值。这就从结构角度漂亮地阐释了RIPK1-RIPK3复合物激活细胞程序性坏死的分子基础。
研究结果表明,具有RHIM结构域的蛋白,如TLR信号通路中TRIF及胞质DNA感知蛋白DAI都能高聚成纤维,并可阻断RIPK3介导的细胞坏死。因此,异源淀粉样复合物可能在天然免疫应答中起着十分重要的功能作用,最终介导不同的细胞命运如细胞死亡、NF-kB转录激活等。
复旦大学生命科学学院李继喜教授和复旦大学生命科学学院分别是本文的共同第一作者和共同第一完成单位。李继喜教授团队主要从事病原体-宿主天然免疫应答相关蛋白质复合物的结构基础与分子机制研究,并于2017年在《美国科学院院刊》(PNAS)和《免疫学》(Immunity)等顶级杂志上发表细菌感染引起炎性坏死和NF-kB信号转导的重要进展(Kuang et al 2017, PNAS; Kleino et al 2017, Immunity)。本研究项目得到了科技部重点研发计划和国家自然科学基金委的资助。
新闻链接:https://news.fudan.edu.cn/2018/0422/c4a55239/page.htm